A advocacia desempenha um papel fundamental na construção de instituições democráticas e livres em um estado de direito. Os advogados e as advogadas são defensores incansáveis da equidade e da verdade, em prol da lei como força unificadora
VOCÊ PRECISA DE UM ADVOGADO HOJE?
CONTATO
CONTATO
Advogado é um profissional liberal, graduado em Direito e autorizado pelas instituições competentes de cada país a exercer o jus postulandi, ou seja, a representação dos legítimos interesses das pessoas físicas ou jurídicas em juízo ou fora dele, quer entre si, quer ante o Estado.
CONTATO
CONTATO
Eduardo Alvares de Carvalho¹
Luís Felipe Nóbrega Coelho²
Cristina Leite Lima³
Sumário: Introdução. 1. Objetivo. 2.Métodos. 3 Relato de caso. 3.1 Histórico e Demandas Apresentadas. 3.2 Fundamentação da Sentença 4. Discussão. 4.1 Diferença entre medicamento e produto medicinal. 4.2 Regulamentação da Cannabis no Brasil: Enquadramento como Produto. 4.3 Qualificação Jurídica como Medicamento. 4.4 Judicialização da Saúde e o Direito à Saúde. 4.5 Uso do Canabidiol no Tratamento do TEA. 4.6 Impactos Econômicos e Éticos 5. Conclusão. 6. Referências.
RESUMO: A judicialização da saúde no Brasil tem crescido significativamente, refletindo os desafios na efetivação do direito à saúde como garantia fundamental, especialmente em demandas envolvendo tratamentos experimentais e de alto custo. Este artigo analisa o caso de uma paciente com Transtorno do Espectro Autista (TEA), cuja solicitação judicial para fornecimento de canabidiol (CBD) foi negada, destacando as implicações jurídicas e clínicas da decisão. Baseada na ausência de registro sanitário pela ANVISA, insuficiência de evidências científicas e alto custo do tratamento, a sentença reforça a necessidade de alinhar decisões judiciais aos critérios técnicos e aos princípios constitucionais da eficiência e sustentabilidade do Sistema Único de Saúde (SUS). O estudo aborda as limitações regulatórias do CBD no Brasil, sua classificação como “produto” e não “medicamento”, e os impactos econômicos e éticos dessa distinção. Conclui-se pela importância de maior integração entre ciência, direito e políticas públicas, com decisões pautadas em medicina baseada em evidências para garantir acesso responsável e equitativo a novas terapias.
PALAVRAS-CHAVE: Judicialização da Saúde; Canabidiol; Direito à Saúde; TEA; ANVISA.
ABSTRACT: The judicialization of healthcare in Brazil has grown significantly, reflecting the challenges in implementing the right to health as a fundamental guarantee, especially in cases involving experimental and high-cost treatments. This article analyzes the case of a patient with Autism Spectrum Disorder (ASD), whose judicial request for the provision of cannabidiol (CBD) was denied, highlighting the legal and clinical implications of the decision. Based on the absence of regulatory approval by ANVISA, insufficient scientific evidence, and the high cost of the treatment, the ruling emphasizes the need to align judicial decisions with technical criteria and the constitutional principles of efficiency and sustainability of the Unified Health System (SUS). The study addresses the regulatory limitations of CBD in Brazil, its classification as a “product” rather than a “medicine,” and the economic and ethical impacts of this distinction. It concludes by stressing the importance of greater integration between science, law, and public policy, with decisions guided by evidence-based medicine to ensure responsible and equitable access to new therapies.
KEYWORDS: Health Judicialization; Cannabidiol; Right to Health; ASD; ANVISA.
___________________________
¹Especialista em Direito Processual Moderno. Mestrando em prestação jurídica e direitos humanos pela UFT e em direitos humanos e segurança pública pela Universidade Estadual de Roraima (UERR).
² Bacharel em direito, especialista em Direito Civil pela EPD. Tribunal de Justiça de Roraima.
³ Bacharela em direito. Tribunal de Justiça de Roraima.
INTRODUÇÃO
A Constituição Federal de 1988 consagra a saúde como um direito fundamental de todos e um dever do Estado, estabelecendo a responsabilidade pela formulação e execução de políticas sociais e econômicas que garantam o acesso universal e igualitário aos serviços de saúde (4). Contudo, a efetivação desse direito enfrenta desafios significativos, evidenciados pelo aumento da judicialização da saúde no Brasil, especialmente em demandas envolvendo tratamentos de alto custo ou tecnologias inovadoras. Dados do Conselho Nacional de Justiça apontam em uma série histórica entre os anos de 2020 e 2024 o aumento progressivo de casos novos por ano e em 31/10/2024 somavam 311.510 processos novos (5). Esse fenômeno levanta debates sobre os limites da atuação judicial em questões de saúde e os impactos econômicos e éticos decorrentes.
__________________________
4. Art. 196. A saúde é direito de todos e dever do Estado, garantido mediante políticas sociais e econômicas que visem à redução do risco de doença e de outros agravos e ao acesso universal e igualitário às ações e serviços para sua promoção, proteção e recuperação. (CF)
5. Disponível em: https://justica-em-numeros.cnj.jus.br/painel-saude/. Acesso em 02/12/2024.
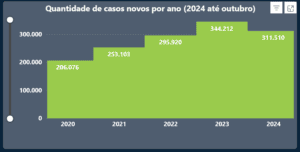
Fonte: CNJ
Entre as questões mais desafiadoras encontra-se o uso de canabidiol (CBD) para fins medicinais, incluindo o tratamento de sintomas associados ao Transtorno do Espectro Autista (TEA). No Brasil, o CBD é regulamentado como “produto” pela Agência Nacional de Vigilância Sanitária (ANVISA) e sua incorporação no Sistema Único de Saúde (SUS) é restrita, devido à ausência de comprovação científica robusta de eficácia e segurança para diversas condições clínicas. A classificação regulatória e as limitações científicas representam barreiras jurídicas e técnicas à sua disponibilização no sistema público, gerando conflitos entre o direito individual à saúde e a sustentabilidade coletiva do SUS.
Este artigo analisa um caso emblemático em que uma paciente com TEA, refratária às abordagens terapêuticas convencionais, pleiteou judicialmente o fornecimento de CBD, tendo o pedido negado com base em critérios regulatórios, econômicos e científicos. A análise detalha as implicações jurídicas e clínicas da decisão, à luz dos princípios constitucionais e das diretrizes de saúde pública, abordando os desafios impostos pela judicialização e pela introdução de novas tecnologias no SUS. Além disso, destaca-se a necessidade de alinhamento entre decisões judiciais, critérios técnicos e os princípios de equidade e eficiência que regem o sistema de saúde no Brasil.
- OBJETIVO
Apresentar um relato de caso sobre ação judicial em que se pleiteia a dispensação judicial do produto Canabidiol CannFly Broad Spectrumalega para tratamento do TEA e explorar os desafios legais, técnicos e éticos do caso, considerando a jurisprudência, os protocolos clínicos e os impactos na gestão do SUS.
- MÉTODOS
Este foi um relato de caso conduzido no Tribunal de Justiça de Roraima, Boa Vista, Roraima, Brasil. Este estudo segue as recomendações do Consensus-based Clinical Case Reporting Guideline Development (CARE), com análise documental detalhada dos autos judiciais, incluindo laudo médico, sentença e fundamentos técnicos da decisão judicial. A revisão integrativa considerou literatura científica nacional e internacional sobre CBD e TEA, incluindo protocolos clínicos e regulamentações sanitárias.
- RELATO DE CASO
3.1 Histórico e Demandas Apresentadas
Paciente do sexo feminino, 8 anos, com diagnóstico de Transtorno do Espectro Autista (TEA), enfrenta um quadro clínico severo com múltiplas comorbidades. Desde a infância, apresenta atraso no desenvolvimento da fala, seletividade alimentar, sensibilidade sensorial, dificuldade de interação social e comportamentos agressivos e impulsivos. Seu histórico inclui insônia refratária, resistência ao convívio social e limitações significativas na funcionalidade escolar e pessoal.
Apesar de diversas intervenções terapêuticas, incluindo acompanhamento neurológico, psiquiátrico e terapias multiprofissionais, associadas ao uso de uma ampla gama de medicamentos psicotrópicos, não houve resposta clínica satisfatória. A paciente apresentou efeitos colaterais graves aos medicamentos disponíveis, como irritabilidade, ganho de peso, ansiedade exacerbada e reações paradoxais.
Dado o insucesso das abordagens convencionais, o médico assistente recomendou o uso de Canabidiol (CBD) importado, baseado em evidências de estudos científicos que demonstram eficácia no manejo de sintomas comportamentais e ansiedade em pacientes com TEA. O laudo destaca o perfil de segurança do CBD e justifica sua prescrição como alternativa terapêutica diante do quadro refratário da paciente, visando melhorar sua funcionalidade e qualidade de vida. Foi solicitado o uso regular e contínuo de Cannfly Broad Spectrum 6000, em dose ajustável conforme evolução clínica.
Ingressou com ação judicial para obter o fornecimento do produto de alto custo, não registrado na ANVISA. O pedido incluiu a concessão de tutela de urgência para que o Estado de Roraima custeasse seis frascos mensais do produto, totalizando um custo anual estimado de R$ 178.130,88. A defesa do Estado argumentou que o canabidiol solicitado não possui registro na ANVISA, conforme exigido pela legislação sanitária e jurisprudência consolidada no Tema 106 do STJ, e que não há comprovação científica de sua eficácia para o tratamento do TEA. Parecer Ministerial opinando pela procedência do pedido. Vieram os autos conclusos para sentença.
3.2 Fundamentação da Sentença
O Juízo de 1ª Instância negou o pedido com base em três pilares principais:
Ausência de Registro na ANVISA: O canabidiol solicitado não possui registro sanitário, o que viola a RDC nº 327/2019. A sentença também destacou que a regulação brasileira classifica o canabidiol como “produto” e não como “medicamento”, exigindo comprovação de eficácia e segurança antes de sua incorporação no SUS.
Falta de Evidências Científicas: A decisão considerou a insuficiência de estudos clínicos robustos que validem o uso do canabidiol no tratamento de TEA, diferentemente de outras indicações, como epilepsias raras.
Princípio da Eficiência: Foi ponderado que o fornecimento de um produto sem comprovação de eficácia e a um custo elevado representaria risco à sustentabilidade financeira do SUS, comprometendo a assistência a outros pacientes.
A sentença citou como base as orientações do STF nos Temas 793, 500, 1161, 6 e 1234 e do STJ no Tema 106, que estabelecem parâmetros para o fornecimento judicial de medicamentos.
- DISCUSSÃO
4.1 Diferença entre medicamento e produto medicinal
No Brasil, essas diferenças são estabelecidas pela legislação sanitária e reguladas pela Agência Nacional de Vigilância Sanitária (Anvisa).
- Medicamento
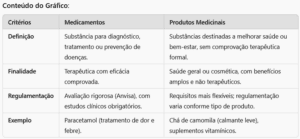
Definição: Substância ou combinação de substâncias destinada a prevenir diagnosticar, tratar ou aliviar doenças ou condições de saúde em seres humanos.
Finalidade: Apresenta indicações terapêuticas específicas, embasadas em evidências científicas, e sua eficácia e segurança são avaliadas em estudos clínicos.
Regulamentação: Precisa de registro na Anvisa, que avalia a eficácia, segurança e qualidade do produto.
Classificação: Pode ser subdividido em:
Medicamentos de referência: Produto inovador com marca registrada e eficácia comprovada.
Genéricos: Cópias de medicamentos de referência, com o mesmo princípio ativo, forma farmacêutica e via de administração, mas sem marca.
Similares: Produtos com os mesmos princípios ativos, mas com diferenças em excipientes ou na apresentação.
Exemplo: Paracetamol (usado para aliviar dor e febre) (6).
- Produto Medicinal
Definição: Termo mais abrangente que pode incluir substâncias, compostos ou preparações destinadas a melhorar a saúde ou o bem-estar, mas que nem sempre possuem comprovação científica de eficácia terapêutica específica.
Finalidade: Pode englobar itens utilizados para benefícios gerais à saúde, como fitoterápicos, suplementos alimentares e cosméticos com alegações de saúde.
Regulamentação: Dependendo do tipo de produto medicinal, as exigências podem ser menos rigorosas do que as aplicadas aos medicamentos. Por exemplo, um suplemento alimentar não passa por avaliações clínicas tão detalhadas quanto um medicamento.
Exemplo: Produtos fitoterápicos (como chá de camomila), suplementos vitamínicos e alguns cosméticos medicinais (7).
_________________________
6. ANVISA. O que devemos saber sobre medicamentos.2010. Brasília. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/medicamentos/publicacoes-sobre-medicamentos/o-que-devemos-saber-sobre-medicamentos.pdf. Acesso em 02/12/2024.
7. 7. ANVISA. O que devemos saber sobre medicamentos.2010. Brasília. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/medicamentos/publicacoes-sobre-medicamentos/o-que-devemos-saber-sobre-medicamentos.pdf. Acesso em 02/12/2024.
Resumo:
Fonte: autores
4.2 Regulamentação da Cannabis no Brasil: Enquadramento como Produto
Regulamentando os preceitos constitucionais sobre o direito à saúde foi editada a Lei 8.080/90, a qual estabeleceu normas de organização das ações e serviços de saúde.
Logo no caput e §1º do art. 2º, a referida Lei reitera a caracterização da saúde como direito fundamental e ratifica a obrigação do Estado de prover os serviços necessários à sua implementação.
Inicialmente, torna-se mister perquirir a natureza jurídica do canabidiol (CBD), investigando sua classificação como produto ou medicamento no contexto regulatório brasileiro. A Agência Nacional de Vigilância Sanitária (Anvisa), por meio da Resolução RDC nº 327/2019, autorizou a importação de produtos derivados de cannabis para fins medicinais, estabelecendo critérios regulatórios para sua comercialização e utilização no Brasil.
Contudo, é importante ressaltar que tais produtos não foram avaliados como medicamentos, dado que, até o momento, não há evidências clínicas robustas que comprovem, de maneira consistente e universal, sua efetividade para condições específicas de saúde. Essa limitação científica levou a Anvisa a classificar esses itens como “produtos” e não como medicamentos, impondo restrições que visam assegurar o uso racional e controlado.
Nesse sentido, a Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC) avaliou o uso do canabidiol apenas para epilepsias refratárias, concluindo pela não incorporação ao SUS devido à insuficiência de evidências científicas sobre sua eficácia e segurança para outras condições, como o Transtorno do Espectro Autista (TEA) (8). Essa posição reforça a necessidade de fundamentação científica robusta eevidência que a ausência de comprovação sobre a efetividade de tais produtos inviabiliza sua disponibilização indiscriminada no sistema público de saúde. Ademais, observa-se que esse mesmo entendimento é adotado em outros contextos regulatórios internacionais, como nos Estados Unidos e na União Europeia.
___________________________
8. CONITEC. Relatório de recomendação medicamento. Brasília. 2021. Disponível em: https://www.gov.br/conitec/pt-br/midias/consultas/relatorios/2021/20210319_relatorio_canabidiol_epilepsia_refrataria_cp_12.pdf. Acesso em 02/12/2024
Nos Estados Unidos, a Food and Drug Administration (FDA) aprovou o uso do Epidiolex, medicamento à base de canabidiol, exclusivamente para condições raras e específicas, como as síndromes de Lennox-Gastaut e Dravet, após estudos clínicos rigorosos (9). De forma semelhante, na União Europeia, derivados de cannabis são tratados como “novos alimentos” (novel foods), sendo submetidos a processos extensivos de autorização e controle antes de qualquer uso medicinal (10).
Tais regulamentos reforçam que, até o momento, o uso de produtos derivados de cannabis para fins medicinais permanece restrito, justamente pela ausência de comprovações científicas amplamente validadas. Assim, a ausência de avaliação científica robusta sobre a eficiência e segurança do produto pleiteado pela parte autora, aliada à classificação de tais itens como “produtos” e não medicamentos, inviabiliza seu fornecimento indiscriminado e sem as devidas cautelas técnico-científicas.
De rigor há distinção conceitual entre medicamento e produto, de acordo com a Lei nº 5.991/1973, que dispõe sobre o Controle Sanitário do Comércio de Drogas, Medicamentos, Insumos Farmacêuticos e Correlatos, e dá outras Providências (11).
Como se verifica, o artigo 4º introduz o produto na classe dos Correlatos, ou seja, utilizados no diagnóstico, prevenção ou tratamento de doenças, mas que não são medicamentos (como materiais hospitalares e instrumentos). O conceito de “produto” associado ao canabidiol no Brasil está disciplinado pela Resolução RDC nº 327/2019 da Anvisa, que regula os procedimentos para concessão de Autorização Sanitária para fabricação e importação de Produtos de Cannabis.
Nos termos do artigo 3º, inciso IX, da referida resolução, um Produto de Cannabis é definido como “produto industrializado, objeto de Autorização Sanitária pela Anvisa, destinado à finalidade medicinal, contendo como ativos, exclusivamente, derivados vegetais ou fitofármacos da Cannabis sativa.”
_________________________________
9. Disponível em: https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-comprised-active-ingredient-derived-marijuana-treat-rare-severe-forms. Acesso em: 02/12/2024.
10. SILVA, R. F. DE O. E .; FIGUEIREDO, E. N.. Current legislation on medical cannabis in the European Union: historical background, movements, trends, and counter-trends lessons for Brazil. BrJP, v. 6, p. 93, 2023. Disponível em: https://www.scielo.br/j/brjp/a/h58wmKqMxZWsMyJZBJTLSNS/?format=pdf&lang=pt. Acesso em 02/12/2024.
11. Art. 4º – Para efeitos desta Lei, são adotados os seguintes conceitos:
[…]
II – Medicamento – produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico;
[…]
IV – Correlato – a substância, produto, aparelho ou acessório não enquadrado nos conceitos anteriores, cujo uso ou aplicação esteja ligado à defesa e proteção da saúde individual ou coletiva, à higiene pessoal ou de ambientes, ou a fins diagnósticos e analíticos, os cosméticos e perfumes, e, ainda, os produtos dietéticos, óticos, de acústica médica, odontológicos e veterinários.
Dessa forma, os Produtos de Cannabis não são classificados como medicamentos, mas sim como uma categoria regulatória própria, com regras específicas de controle, monitoramento e autorização sanitária. Essa diferenciação é relevante para a análise do caso sub examine, pois reforça a inexistência de registro como medicamento e limita sua inclusão no Sistema Único de Saúde (SUS).
Nesse contexto, destaca-se que o composto CBD (canabidiol) é regulamentado pela Anvisa para fins medicinais, exigindo prescrição médica e estando disponível em diferentes formas farmacêuticas. Diferentemente do THC (tetrahidrocanabinol), não possui efeitos psicoativos e tem sido empregado em casos específicos, como dor crônica e epilepsia, sob regulamentação.
Essa distinção é fundamental, pois reflete o entendimento do Tema 1161 do STF, que condiciona o fornecimento de medicamentos sem registro na Anvisa à autorização excepcional pela agência de vigilância sanitária, desde que demonstrada sua imprescindibilidade clínica. Contudo, a classificação do CBD como “produto” no Brasil altera substancialmente o substrato legal que embasa decisões judiciais relacionadas a tratamentos medicinais.
Por exemplo, o artigo 19-T da Lei nº 12.401/2011 veda o pagamento, ressarcimento ou reembolso, no âmbito do SUS, de medicamentos experimentais ou sem autorização da Anvisa, estendendo essa proibição a produtos sem registro no órgão regulador.
Ainda assim, a Lei nº 14.313/2022 trouxe exceções a essa regra, cuja aplicação depende de circunstâncias excepcionais e regulamentações específicas. Dessa forma, o reconhecimento do CBD como “produto” e não como “medicamento” implica limitações jurídicas e regulatórias significativas, que inviabilizam a extensão de sua cobertura no SUS ou a obrigatoriedade de seu fornecimento pelo Estado sem observância estrita às normas vigentes.
Tanto produto quanto medicamentos com uso diferente do registrado na Anvisa podem ser aceitos se recomendados pela Conitec, com evidências científicas comprovadas e protocolo do Ministério da Saúde; e produtos recomendados pela Conitec obtidos por meio de organismos multilaterais internacionais para programas de saúde pública do Ministério da Saúde e entidades vinculadas.
O artigo 19-Q da Lei Nº 8.080, de 19 de setembro de 1990, dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências (12).
Dessa feita, salvo as exceções legais, são vedadas em todas as esferas de gestão do SUS a dispensação, o pagamento, o ressarcimento ou o reembolso de medicamento e produto, nacional ou importado, sem registro na Anvisa ou de uso experimental(13).
___________________________________
12. Art. 19-Q. A incorporação, a exclusão ou a alteração pelo SUS de novos medicamentos, produtos e procedimentos, bem como a constituição ou a alteração de protocolo clínico ou de diretriz terapêutica, são atribuições do Ministério da Saúde, assessorado pela Comissão Nacional de Incorporação de Tecnologias no SUS. (Incluído pela Lei nº 12.401, de 2011);
13. Art. 19-T.
I – o pagamento, o ressarcimento ou o reembolso de medicamento, produto e procedimento clínico ou cirúrgico experimental, ou de uso não autorizado pela Agência Nacional de Vigilância Sanitária – ANVISA; (Incluído pela Lei nº 12.401, de 2011)
II – a dispensação, o pagamento, o ressarcimento ou o reembolso de medicamento e produto, nacional ou importado, sem registro na Anvisa. (Incluído pela Lei nº 12.401, de 2011)
Parágrafo único. Excetuam-se do disposto neste artigo: (Incluído pela Lei nº 14.313, de 2022)
I – medicamento e produto em que a indicação de uso seja distinta daquela aprovada no registro na Anvisa, desde que seu uso tenha sido recomendado pela Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (Conitec), demonstradas as evidências científicas sobre a eficácia, a acurácia, a efetividade e a segurança, e esteja padronizado em protocolo estabelecido pelo Ministério da Saúde; (Incluído pela Lei nº 14.313, de 2022)
II – medicamento e produto recomendados pela Conitec e adquiridos por intermédio de organismos multilaterais internacionais, para uso em programas de saúde pública do Ministério da Saúde e suas entidades vinculadas, nos termos do § 5º do art. 8º da Lei nº 9.782, de 26 de janeiro de 1999. (Incluído pela Lei nº 14.313, de 2022) ( Vide Art. 19-T. Incluído pela Lei nº 12.401, de 2011)
Vejamos que o Canabidiol não preenche os requisitos legais. O Protocolo Clínico e Diretrizes Terapêuticas do Comportamento Agressivo no Transtorno do Espectro do Autismo PCDT ao analisar se o uso de Canabinoides são eficazes e seguros para tratamento do comportamento agressivo do transtorno do espectro do autismo, concluiu que estudos clínicos randomizados, controlados por placebo, com metodologia e padrões adequados de relato são necessários para que se possa apoiar ou refutar a indicação de canabinoides para tratamento do comportamento agressivo em pacientes com TEA (14). Não há PCDT para o uso de Canabinoides em outras sintomatologias ligadas ao TEA.
De acordo com informações oficiais obtidas no sítio do Governo Federal, por meio da Resolução RE n° 3.893, emitida em 24 de novembro de 2022, a Anvisa deu aval para a produção nacional denominado CANABIDIOL EASE LABS 100 MG/ML. O item será produzido no Brasil pela empresa EASE LABS LABORATÓRIO FARMACÊUTICO LTDA como produto, na apresentação de uma solução oral que contém 100 mg/mL de canabidiol (CBD), com concentração máxima de 0,2% de tetrahidrocanabinol (THC). Para adquirir o item em estabelecimentos farmacêuticos, é obrigatória apresentação de receituário médico especial tipo B, identificado pela cor azul.
A RDC 185/2001 define produto médico como aquele “que não utiliza meio farmacológico, imunológico ou metabólico para realizar sua principal função”. Já o medicamento caracteriza-se pela ação farmacológica e necessidade de registro específico. Ela estabelece o regulamento técnico para registro, alteração, revalidação e cancelamento de registro de produtos médicos na ANVISA.
Já RDC 327/2019 estabelece os procedimentos para autorização, fabricação, importação e comercialização de produtos de Cannabis para fins medicinais no Brasil. Esta aprovação representa o 23º produto à base de Cannabis autorizado pela Anvisa sob a RDC n° 327/2019, sendo que deste total, 9 à base de extratos de Cannabis sativa e 14 de canabidiol. Nesse diapasão, a RDC 327 estabelece os procedimentos para Autorização Sanitária de fabricação, importação e comercialização de produtos de Cannabis para fins medicinais.
__________________________
14. Disponível em: file:///C:/Users/Magistrado/Downloads/20220419_PORTAL-Portaria_Conjunta_7_Comportamento_Agressivo_TEA-1.pdf. Acesso em:02/12/2024.
A Resolução da Diretoria Colegiada, que é um ato normativo emitido pela ANVISA para estabelecer regras e diretrizes sobre questões específicas de vigilância sanitária, tem força de lei e deve ser cumprida por todos os envolvidos no setor regulado, determina que estes produtos devem conter predominantemente CBD e no máximo 0,2% de THC, exceto para cuidados paliativos em casos terminais. A prescrição é restrita a médicos habilitados e deve ocorrer apenas quando esgotadas outras opções terapêuticas disponíveis no mercado brasileiro.
Assim, no Brasil, apenas o Mevatyl possui registro como medicamento contendo canabidiol e é indicado para o tratamento sintomático da espasticidade moderada a grave relacionada à esclerose múltipla.
Os demais produtos, incluindo os importados, são classificados como produtos para saúde, tendo um processo de registro simplificado, sem exigência de bula e com estudos de eficácia e segurança menos rigorosos. Essa distinção técnico-regulatória tem implicações importantes pois deixa esses produtos fora dos Temas 1161 e 1234 do STF (aplicação somente para o caso de medicamentos) e impossibilita comparações de equivalência ou análise de alternativas mais econômicas, devido à ausência de bula.
Conforme articulado pormenorizadamente, infere-se, portanto, que a natureza do objeto jurídico em análise implica diretamente em suas consequências normativas e práticas. Esse aspecto revela-se evidente, na medida em que a autorização da ANVISA para a importação de derivados da cannabis sob a classificação de “produto”, e não como “medicamento”, altera substancialmente a aplicação de temas consolidados no ordenamento jurídico pátrio, os quais regem a regulação de medicamentos não incorporados ao Sistema Único de Saúde (SUS).
Essa classificação singular, conferida pela Agência Reguladora, suscita questionamentos sobre a aplicabilidade dos paradigmas jurídicos e regulatórios tradicionalmente utilizados, considerando, ainda, a ausência de critérios de avaliação técnico-científica exigidos para medicamentos.
Ademais, observa-se que a opção pelo registro como “produto” cria um campo normativo que beneficia, em certa medida, as empresas farmacêuticas detentoras de patentes específicas sobre derivados da cannabis. Isso ocorre porque, ao não se submeterem às regras de regulação ordinárias, tais como as avaliações de custo-efetividade e segurança conduzidas pela Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC), bem como à definição de preços máximos de comercialização pela Câmara de Regulação do Mercado de Medicamentos (CMED), essas empresas ficam alijadas de obrigações que seriam impostas no caso de registro como medicamento.
Ressalte-se que, sob a perspectiva jurídica, a escolha pela classificação como “produto” pode ser considerada vantajosa para agentes econômicos internacionais, na medida em que permite maior flexibilidade comercial e regulatória, ao mesmo tempo em que transfere aos consumidores os riscos e custos de utilização.
Essa dinâmica, embora amparada em permissivos regulatórios, fragiliza o equilíbrio entre o direito à saúde e a proteção ao consumidor, pilares fundamentais da Constituição da República e do ordenamento jurídico infraconstitucional.
Por fim, a análise da natureza jurídica da classificação de derivados da cannabis como “produto” exige uma interpretação teleológica e sistemática das normas aplicáveis, considerando a finalidade última de promover o bem-estar social e assegurar a eficácia das políticas públicas de saúde.
Não custa repisar que a exclusão de tais produtos dos marcos regulatórios mais rigorosos pode gerar precedentes preocupantes, sobretudo no que tange à uniformidade das políticas de saúde pública e à proteção de direitos fundamentais, como o acesso equitativo a tratamentos eficazes e seguros.
Doutro norte, vislumbra-se uma clara desvantagem que merece destaque, considerando que os pacientes ficam privados de acesso ao “produto”, haja vista a vedação de fornecimento ou incorporação no âmbito do Sistema Único de Saúde (SUS).
Esse cenário decorre de um aparente conflito normativo e regulatório, sobretudo à luz do artigo 19-Q da Lei nº 8.080, de 19 de setembro de 1990, que disciplina as condições para a promoção, proteção e recuperação da saúde, bem como a organização e o funcionamento dos serviços correspondentes.
O referido dispositivo legal estabelece parâmetros que visam assegurar o acesso universal e igualitário às ações e serviços de saúde, destacando a necessidade de regulamentação e controle efetivos para a incorporação de tecnologias em saúde no SUS.
No entanto, a classificação de determinados derivados da cannabis como “produtos” e não como “medicamentos” afasta-os do escopo de análise da CONITEC e, por conseguinte, da possibilidade de serem incorporados ao sistema público.
Tal configuração normativa implica em significativa limitação ao direito de saúde dos pacientes, os quais, apesar de necessitarem do “produto” para tratamento, não podem contar com sua oferta pelo SUS, uma vez que este não atende aos critérios jurídicos e técnicos exigidos pela legislação vigente
A situação gera um cenário de desigualdade, transferindo os custos e os riscos do tratamento exclusivamente para o setor público, o que contraria, em certa medida, os princípios fundamentais de equidade e integralidade que regem o Sistema Único de Saúde, conforme preconizado na Constituição Federal.
Em última análise, a incompatibilidade entre a classificação jurídica como “produto” e as disposições do artigo 19-Q da Lei nº 8.080/1990 demanda reflexão crítica sobre o impacto de tais decisões regulatórias na efetividade das políticas públicas de saúde e na concretização do direito à saúde como garantia fundamental.
4.3 Qualificação Jurídica como Medicamento
Inicialmente, a análise da tese sob a ótica da incorporação pela Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC) tem sido afastada pela jurisprudência pátria. Tal entendimento se consolida diante do reconhecimento de que, embora os derivados da cannabis sejam admitidos para importação como “produtos”, a finalidade intrínseca de tais substâncias alinha-se à categoria de medicamentos, dada sua aplicação clínica em tratamentos específicos. Nesse contexto, registra-se, obiter dictum, o caso paradigmático do Tema 1.161 do Supremo Tribunal Federal, que aborda, de forma específica, medicamentos à base de canabidiol.
Consoante decidido no Recurso Extraordinário n.º 1.165.959/SP, o Plenário do STF fixou a tese: “Cabe ao Estado fornecer, em termos excepcionais, medicamento que, embora não possua registro na ANVISA, tem a sua importação autorizada pela agência de vigilância sanitária, desde que comprovada a incapacidade econômica do paciente, a imprescindibilidade clínica do tratamento, e a impossibilidade de substituição por outro similar constante das listas oficiais de dispensação de medicamentos e os protocolos de intervenção terapêutica do SUS.”
A decisão demonstra que a ausência do registro sanitário não deve ser interpretada como impeditivo absoluto ao fornecimento, quando preenchidos os requisitos que conferem excepcionalidade à demanda. Nesse sentido, o Tribunal reconheceu a singularidade do medicamento à base de canabidiol ao observar que sua utilização, embora classificada como “produto” pela ANVISA, possui clara destinação terapêutica, enquadrando-se nas hipóteses excepcionais de assistência estatal previstas no ordenamento jurídico.
Portanto, o reconhecimento da finalidade medicamentosa dos derivados de cannabis impõe uma análise jurídica e técnica que transcende a mera classificação administrativa, considerando os impactos no direito à saúde e no acesso aos tratamentos eficazes para pacientes hipossuficientes. Esse entendimento, ancorado na jurisprudência consolidada, evidencia a necessidade de compatibilizar a regulação sanitária com os direitos fundamentais, promovendo o equilíbrio entre os limites administrativos e a proteção integral à saúde pública.
O reconhecimento da aplicação dos Temas 106 e 1234 aos casos que envolvem medicamentos à base de canabidiol tem sido frequente na jurisprudência, considerando-se as especificidades de cada caso concreto.
O Tribunal de Justiça de São Paulo, ao analisar a Apelação Cível n.º 1020334-39.2024.8.26.0053, reafirmou a necessidade de rigorosa observância dos critérios estabelecidos nos referidos temas, sem adentrar questões relativas à classificação formal do produto pela ANVISA.
Nesse julgamento, foi destacado que o fornecimento de medicamentos não incorporados ao SUS exige o cumprimento cumulativo de requisitos fixados pelo Tema 106 do STJ, como: “(i) comprovação de imprescindibilidade ou necessidade do medicamento, com a demonstração de que as alternativas fornecidas pelo SUS são ineficazes; (ii) incapacidade financeira do autor; e (iii) existência de registro do medicamento na ANVISA.” Além disso, o Tema 1161 do STF acrescenta que, na ausência de registro, o fornecimento pode ocorrer de maneira excepcional, desde que demonstrada a imprescindibilidade clínica e a inexistência de substitutos terapêuticos disponíveis no SUS.
Especificamente no caso em análise, o pedido foi negado devido à ausência de comprovação de que o medicamento pleiteado seria indispensável e que as alternativas terapêuticas oferecidas pelo SUS seriam ineficazes. Também se verificou a inexistência de evidências científicas robustas que justificassem o uso do fármaco em questão, conforme exigido pelos Temas 6 e 1234 do STF, que requer a fundamentação em Medicina Baseada em Evidências, incluindo ensaios clínicos randomizados e revisões sistemáticas.
Portanto, a decisão reitera que, nos pleitos relacionados a medicamentos à base de canabidiol, o autor deve atender integralmente aos requisitos impostos pelos temas mencionados. O julgamento não aborda aspectos relacionados à classificação formal do produto como “medicamento” ou “produto” pela ANVISA, mas se concentra nos critérios objetivos e técnicos para garantir a segurança, eficácia e necessidade clínica do fármaco requerido, priorizando a racionalidade e a eficiência das políticas públicas de saúde.
Transcreve-se a ementa do referido julgado: “APELAÇÃO CÍVEL. AÇÃO ORDINÁRIA C/C PEDIDO DE TUTELA DE URGÊNCIA. SAÚDE. FORNECIMENTO DE MEDICAMENTO. Autor portador de Transporto Bipolar do Humor (CID 10 F31). Prescrição médica de “Canabidiol Cannfly Broad Spectrum 6000mg”. Medicamento importado, de marca específica e alto custo. Ausência de registro na Anvisa. Médica instalada em Petrópolis/RJ, enquanto o autor reside no Estado de São Paulo. Laudo médico que não logrou demonstrar a ineficácia das alternativas disponíveis na rede pública, a impedir que se exija do Estado o fornecimento do fármaco. Descumprimento dos requisitos contidos no Tema 106, do STJ, bem como nos Temas 1161 e 1234, do STF. Ausência de justificativa quanto à impossibilidade do uso de qualquer um dos medicamentos à base de canabidiol fornecidos pelo SUS. Sentença de improcedência mantida. RECURSO DESPROVIDO. (TJSP; Apelação Cível 1020334-39.2024.8.26.0053; Relator (a): Paulo Galizia; Órgão Julgador: 10ª Câmara de Direito Público; Foro Central – Fazenda Pública/Acidentes - 8ª Vara de Fazenda Pública; Data do Julgamento: 12/11/2024; Data de Registro: 12/11/2024)”
Sob análise dos critérios técnicos, considerando o produto pleiteado como medicamento e aplicando-se os temas fixados pelo Supremo Tribunal Federal (STF), ainda assim a improcedência da demanda é inevitável.
Isso porque o parecer técnico elaborado pelo Núcleo de Apoio Técnico do Judiciário Estadual (NATJUS/RR) pormenorizou de forma clara e objetiva a ausência de evidências científicas suficientes que sustentem a imprescindibilidade do tratamento com o produto solicitado no caso concreto, em conformidade com os critérios estabelecidos nos Temas 106, 1161, 6 e 1234, assim como nas Súmulas Vinculantes 60 e 61 do STF.
O parecer destacou que, “tendo em vista os elementos apresentados e a literatura científica consultada, não foram identificados elementos técnicos indicativos de imprescindibilidade de uso do medicamento requerido para o caso concreto, considerando a relação de custo-efetividade”.
Acrescenta-se que parecer técnico-científico sobre derivados da cannabis e seus análogos sintéticos para o tratamento do Transtorno do Espectro Autista (TEA) elaborado pelo Núcleo de Avaliação de Tecnologias em Saúde – Hospital Sírio Libanês (NATS-HSL) em dezembro de 2023 concluiu (15): “Foi identificada evidência de baixa certeza de que o extrato de planta integral de cannabis pode aumentar a proporção de pacientes com melhor escore global de sintomas em 12 semanas quando comparado ao placebo. O efeito do extrato purificado neste mesmo desfecho é incerto. A certeza da evidência foi rebaixada devido problemas metodológicos e baixo tamanho amostral nos estudos incluídos.
_____________________________
15. Disponível em: https://www.pje.jus.br/e-natjus/arquivo-download.php?hash=4893e59cbbb6e3851cd46728a0cfdf3d1697d8b1. Acesso em:02/12/2022.
O efeito na proporção de pacientes com eventos adversos graves é incerto tanto para o extrato de planta integral quanto para o extrato purificado. Os desfechos gravidade dos sintomas, quaisquer eventos adversos e comportamento adaptativo não puderam ser avaliados, pois foram relatados pelos estudos incluídos de maneira insuficiente para análise adequada. O desfecho qualidade de vida não foi avaliada em nenhum dosestudos incluídos. Adicionalmente, não foram encontrados estudos que avaliaram os efeitos da cannabis quando comparada a outras tecnologias, como a risperidona, presente no SUS.”
Além disso, o parecer reforça que o Canabidiol solicitado não possui registro na ANVISA, condição que inviabiliza sua inclusão no Sistema Único de Saúde (SUS) e impede o cumprimento integral dos requisitos dispostos no Tema 106 do Superior Tribunal de Justiça (STJ) e nos Temas 6 e 1234 do STF, especialmente no que diz respeito à comprovação da segurança, eficácia e inexistência de substituto terapêutico disponível no SUS.
No que tange à análise econômica, o custo elevado do medicamento (aproximadamente R$ 178.130,88 anuais) sem comprovação científica robusta torna o pleito ainda mais desarrazoado frente às políticas públicas de saúde.
Essa conclusão assemelha-se à abordagem adotada pelo Tribunal de Justiça de São Paulo no julgamento da Apelação Cível nº 1020334-39.2024.8.26.0053, na qual foi negado o fornecimento de medicamento à base de Canabidiol em razão do não preenchimento dos requisitos necessários à sua concessão, reforçando a necessidade de fundamentação em medicina baseada em evidências e a demonstração de ineficácia das alternativas terapêuticas disponíveis.
Portanto, à luz do parecer técnico, é evidente que, mesmo considerando o Canabidiol como medicamento, o pleito não encontra amparo jurídico ou técnico.
A ausência de evidências científicas de alto nível (estudos randomizados, revisões sistemáticas e meta-análises) e a falta de registro sanitário configuram barreiras intransponíveis para o acolhimento da demanda, reforçando a necessidade de decisões pautadas no equilíbrio entre o direito individual e as políticas públicas de saúde, em conformidade com os princípios constitucionais da eficiência e razoabilidade.
4.4 Judicialização da Saúde e o Direito à Saúde
A judicialização da saúde decorre do caráter vinculante do direito à saúde na Constituição Federal, mas sua aplicação prática encontra limites técnicos e econômicos. Decisões judiciais que determinam o fornecimento de medicamentos não registrados ou sem evidências científicas podem gerar efeitos adversos na gestão pública de saúde, desviando recursos de tratamentos comprovadamente eficazes.
No caso analisado, a ausência de registro na ANVISA foi central para a decisão. O registro sanitário é requisito básico para a disponibilização de medicamentos no SUS, conforme legislação nacional e os Temas 106 e 1161 do STJ e STF. Tal exigência visa proteger a saúde pública, garantindo que apenas produtos seguros e eficazes sejam utilizados.
4.5 Uso do Canabidiol no Tratamento do TEA
O canabidiol, regulamentado no Brasil pela RDC nº 327/2019, é permitido para uso individualizado mediante prescrição médica e importação. Entretanto, a literatura científica ainda carece de estudos de alta qualidade que validem seu uso no tratamento do TEA. Nos Estados Unidos, o Epidiolex foi aprovado pela FDA para epilepsias raras, mas não há indicação formal para TEA, reforçando as lacunas científicas para esta condição.
Embora estudos preliminares apontem benefícios do CBD no manejo de sintomas comportamentais em TEA, a literatura carece de evidências de alta qualidade que sustentem sua eficácia e segurança para essa condição específica. O Protocolo Clínico e Diretrizes Terapêuticas (PCDT) do Ministério da Saúde recomenda a risperidona como primeira linha para comportamentos agressivos em TEA, respaldada por ensaios clínicos e meta-análises rigorosas. A substituição por canabidiol sem critérios claros pode comprometer a equidade e a eficiência do sistema público.
4.6 Impactos Econômicos e Éticos
A ANVISA classifica o CBD como produto medicinal, e não como medicamento, o que limita sua incorporação ao SUS. Regulamentações internacionais, como a aprovação do Epidiolex pelo FDA, também destacam a necessidade de estudos robustos antes de expandir as indicações de uso.
O fornecimento do canabidiol solicitado representaria um custo anual elevado, equivalente ao atendimento de dezenas de pacientes com terapias convencionais e eficazes. O princípio da reserva do possível foi considerado na sentença, alinhando-se ao entendimento de que o direito à saúde deve ser garantido de forma coletiva e sustentável.
A incorporação de tratamentos experimentais e de alto custo no SUS exige cautela para evitar impactos negativos na sustentabilidade do sistema. A decisão judicial baseou-se no princípio da eficiência, priorizando o uso racional dos recursos públicos para atender ao maior número possível de pacientes.
- CONCLUSÃO
O caso analisado ilustra os complexos desafios jurídicos, clínicos e éticos envolvidos na judicialização da saúde no Brasil, especialmente em demandas que envolvem tecnologias emergentes como o canabidiol (CBD). A decisão judicial que negou o fornecimento do CBD à paciente com Transtorno do Espectro Autista (TEA) foi fundamentada em critérios técnicos e legais sólidos, destacando a ausência de registro sanitário pela ANVISA, a insuficiência de evidências científicas robustas para a indicação, e o alto custo do tratamento, que comprometeria a equidade e a sustentabilidade do Sistema Único de Saúde (SUS).
Do ponto de vista regulatório, a classificação do CBD como “produto” e não “medicamento” pela ANVISA reflete a ausência de comprovação científica que sustente sua eficácia e segurança para condições como o TEA, limitando sua inclusão em políticas públicas de saúde. Embora estudos preliminares apontem benefícios potenciais do CBD, a comunidade científica ainda carece de ensaios clínicos controlados e revisões sistemáticas que validem seu uso em contextos além das epilepsias refratárias.
Juridicamente, a decisão seguiu os precedentes estabelecidos pelos Temas 500, 1161, 6, 1234 e 106 do Supremo Tribunal Federal (STF) e Superior Tribunal de Justiça (STJ), que exigem critérios rigorosos para o fornecimento de medicamentos sem registro sanitário, priorizando tratamentos que atendam a padrões elevados de eficácia, segurança e custo-benefício. Assim, a sentença analisada reafirma a importância de decisões judiciais alinhadas à legislação sanitária e às diretrizes de saúde pública, garantindo o equilíbrio entre demandas individuais e o bem coletivo.
______________________________
16. Disponível em: https://www.gov.br/conitec/pt-br/midias/artigos_publicacoes/risperidona_final.pdf. Acesso em:02/12/2024.
A judicialização de tratamentos experimentais e de alto custo, como o uso de CBD para TEA, expõe a necessidade de maior integração entre o Poder Judiciário, a regulação sanitária e as políticas públicas de saúde. Reforça-se a urgência de investimentos em pesquisa clínica nacional, capacitação de magistrados para análise técnica de demandas de saúde e fortalecimento do papel da ANVISA e da CONITEC na regulação e incorporação de novas tecnologias e o fomento de acordos de compartilhamento de riscos entre a indústria farmacêutica e o governo federal.
Por fim, o presente estudo destaca a necessidade de um enfoque baseado em medicina de evidências para a inclusão de novas terapias no SUS, com decisões judiciais que considerem não apenas a proteção ao direito individual à saúde, mas também os princípios constitucionais da eficiência, universalidade e sustentabilidade do sistema público. Apenas com a convergência entre ciência, direito e ética será possível avançar na garantia do acesso equitativo e responsável a tratamentos inovadores.
- REFERÊNCIAS
BARROSO, L. R. Curso de direito constitucional contemporâneo: os conceitos fundamentais e a construção do novo modelo. 9. ed. São Paulo: Saraiva, 2020.
BRASIL. [Constituição (1988), art. 196]. Constituição da República Federativa do Brasil de 1988. Brasília, DF: Presidência da República, [2023]. Disponível em: https://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm. Acesso em: 02 dez. 2024.
BRASIL. Conselho Nacional de Justiça. Recomendação n. 146, de 28 de novembro de 2023. Dispõe sobre estratégias para o cumprimento adequado das decisões judiciais nas demandas de saúde pública. Brasil: CNJ, 2023.
BRASIL. Decreto n. 7.508, de 28 de junho de 2011. Regulamenta a Lei nº 8.080, de 19 de setembro de 1990, para dispor sobre a organização do Sistema Único de Saúde – SUS, o planejamento da saúde, a assistência à saúde e a articulação interfederativa, e dá outras providências.. Brasília, DF: Presidência da República, 2011. Disponível em: https://www.planalto.gov.br/ccivil_03/_ato2011-2014/2011/decreto/d7508.htm. Acesso em: 11 out. 2024.
BRASIL. Lei n. 8.080, de 19 de setembro de 1990. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências. Brasília, DF: Presidência da República, 2002. Disponível em: https://www.planalto.gov.br/ccivil_03/leis/l8080.htm. Acesso em: 11 out. 2024.
BRASIL. Superior Tribunal de Justiça. Recurso Especial n.º 1657156/RJ. Relator: Vice-Presidente do STJ. Recorrente: Estado do Rio de Janeiro. Recorrido: Fátima Theresa Esteves dos Santos de Oliveira. Interessados: Defensoria Pública da União e outros. Brasília, DF, 19 dez. 2022. Disponível em: https://processo.stj.jus.br/repetitivos/temas_repetitivos/pesquisa.jsp?novaConsulta=true&tipo_pesquisa=T&cod_tema_inicial=106&cod_tema_final=106 . Acesso em: 02/12/2024.
Brasil. SUPREMO TRIBUNAL FEDERAL (STF). Recurso Extraordinário 1165959: Processo Eletrônico Público Maior de 60 anos ou portador de doença grave. Tema 1161: Fornecimento de medicamentos não registrados. Relator: Min. Marco Aurélio. Redator do acórdão: Min. Alexandre de Moraes. Origem: Tribunal de Justiça do Estado de São Paulo. Brasília: STF. Disponível em: <l https://portal.stf.jus.br/processos/detalhe.asp?incidente=5559067 >. Acesso em: 02/12/2024.
BRASIL. Supremo Tribunal Federal. Recurso Extraordinário 1366243. Tema 1234 – Processo Eletrônico Público Maior de 60 anos ou portador de doença grave. Relator: Ministro Gilmar Mendes. Brasília: STF. Disponível em: https://portal.stf.jus.br/processos/detalhe.asp?incidente=6335939 . Acesso em: 02/12/2024.
BRASIL. Supremo Tribunal Federal. Recurso Extraordinário 566471. Tema 6 – Processo Eletrônico Público Maior de 60 anos ou portador de doença grave. Relator: Ministro Marco Aurélio. Redator do acórdão: Ministro Luís Roberto Barroso. Brasília: STF. Disponível em: https://portal.stf.jus.br/processos/detalhe.asp?incidente=2565078. Acesso em: 02/12/2024.
BRASIL. Supremo Tribunal Federal. Recurso Extraordinário 657718. Tema 500 – Processo Eletrônico Público Medida Liminar. Relator: Ministro Marco Aurélio. Redator do acórdão: Ministro Luís Roberto Barroso. Brasília: STF. Disponível em: https://portal.stf.jus.br/processos/detalhe.asp?incidente=4143144. Acesso em: 02/12/2024.
CONSELHO NACIONAL DE JUSTIÇA – CNJ. Estatísticas processuais de direito à saúde. Brasília, DF: Conselho Nacional de Justiça. s.d. Disponível em: https://justica-em-numeros.cnj.jus.br/painel-saude/. Acesso em: 02 dez. 2024.
MARTIMBIANCO, R. et al. Saúde Baseada em Evidências – Conceitos, Métodos e Aplicação Prática. 1. ed. São Paulo: Atheneu, 2023.
MENDES, G. et al. Curso de Direito Constitucional. 17. ed. São Paulo: Saraiva Jur, 2022.
NATS-HSLDERIVADOS DA CANNABIS E SEUS ANÁLOGOS SINTÉTICOS PARA EPILEPSIA REFRATÁRIA. São Paulo, 2024. Disponível em: https://www.pje.jus.br/e-natjus/arquivo-download.php?hash=4893e59cbbb6e3851cd46728a0cfdf3d1697d8b1. Acesso em:02/12/2024.
NETO, G.; SCHULZE, C. Direito à Saúde Análise à Luz da Judicialização. 1. ed. Porto Alegre: Verbo Jurídico, 2013.
SÃO PAULO (Estado). Tribunal de Justiça. Apelação Cível n.º 1020334-39.2024.8.26.0053. Relator: Paulo Galizia. Órgão Julgador: 10ª Câmara de Direito Público. Foro Central – Fazenda Pública/Acidentes – 8ª Vara de Fazenda Pública. Julgado em: 12 nov. 2024. Registrado em: 12 nov. 2024.